今日、実験動物を使用するイン・ビボ実験医学分野で世界トップの業績を誇る実中研は、国、教育機関、企業、そのいずれにも属さない、極めてユニークな存在である。 このミュージアムでは実中研の過去から現在に至るまでの70年近い道のりを、実際にあった興味深いエピソードを交えながら紹介していく。
| 年代 | 事項 |
|---|---|
| 1947年 | 野村達次の母増子と姉美智子が神奈川県大磯町の野村邸でマウスの飼育開始 |
| 1951年 | 安東洪次・田嶋嘉雄両博士が実験動物研究会を設立 |
| 1952年 | 実験動物中央研究所を東京都・西多摩郡瑞穂町に設立 野村増子と美智子がスナネズミの実験動物化に成功 |
| 1954年 | 固形飼料の供給開始 |

人生にはその後の生き方を決定づけてしまうような一瞬がある。 実験動物中央研究所(実中研)の前理事長である野村達次の場合、
それは自分の勤め先の東京大学伝染病研究所(伝研)の上司で恩師の安東洪次博士から投げかけられた問いかけであった。
「いま君がやっている実験を掘り下げて、何かの発見に達することも、それなりに意義のあることだ。
しかし他方、君がいま使っている実験動物のレベルを、もう一段引き上げることができれば、それを使う日本の医学の研究水準全体が、確実に一段上がる。君はそのどちらを選ぶか」と。
この問いかけがあった1950年から1951年頃の日本は、まだまだ戦後復興期で人間の食料確保がやっとの時代である。実験動物は農家の副業として片手間で作られていたから、品質などは問うこともできないほど粗悪だった。
1954年、野村達次が医学研究者の道を捨て実験動物生産業者となったのには、こうした背景があった。
だがそのさらに背後には、若き研究者の達次がすでに良質な実験動物を自分で作り出し、実験に使っていたという事実があった。 達次と実験動物の出会い、そのルーツを辿ってみよう。

野村達次が実験動物をそもそも育てようと思ったのには、訳がある。 時は1945年。達次は慶應義塾大学医学部を卒業し、東京大学伝染病研究所(伝研)に就職した。ところが体調不良のため、神奈川県大磯町の自宅で静養せざるを得なくなった。第二次世界大戦直後のこと、高価な実験動物を新米研究者が自由に使わせてもらえるはずがない。そこで達次は、静養している間にせめて自分が実験に使うマウスくらいは自分で育ててみようと思った。その話を聞いた達次の友人で後に達次の妻となった三井長子(ひさこ)が、6匹のつがいのマウスをもらってきてくれた。そのマウスは、長子の父・三井生雄(しげお)が三井化学工業株式会社からもらってきたものである。そして動物好きだった達次の母が、マウスの飼育を引き受けてくれた。これが野村家と実験動物の最初の結びつきとなる。
幾つかの回り道をした達次は1951年に伝研に復帰し、安東洪次博士の研究室に入る。安東博士は戦前・戦中と中国の大連の恵まれた研究所で研究活動をしてきた人である。

だから糞尿とワラが幾重もの層を成し、動物がバタバタと死んでいく戦後日本の劣悪な実験動物の飼育環境に心を痛め、この状況をどうにかしたいと考えた。 当時、同じ建物内に職場があった国立予防衛生研究所(予研)の田嶋嘉雄博士もまた、大陸で潤沢な資金を使っていろいろな実験動物を飼い、研究に使ってきた人である。 したがって安東博士の呼びかけにすぐさま賛同し、両博士は1951年に『実験動物研究会(のちの日本実験動物学会)』を発足させる。
安東・田嶋両博士が率いる『実験動物研究会』は、実験動物の飼育環境改善の重要性を説き、良質な実験動物を社会に提供していくべきだという理念を主張した。 その理念を具体的なかたちにしたのが、野村ファミリーが東京都西多摩郡瑞穂町に築いた『実験動物中央研究所』である。 その建設にあたっては、達次の父、野村駿吉が機械装置一式の資金を、達次の末弟、松方亮三が建物の建設費を用意した。


初期の実験動物の飼育において重要な役割を果たしたのが、達次の母、増子と姉、美智子である。 人間の食料にさえこと欠く時代に、徳川家の瀟洒な別邸だった大磯町の野村邸で、マウスを大切に育てた。 そして飼育部屋を練炭火鉢で暖め、広い庭も菜園に変えてマウスが食べてくれそうな葉野菜を育てるという、まさにマウス中心の生活を送った。 だから瑞穂町の施設に送られる頃には、野村家のマウスは良質な実験動物になっていた。

さらに増子の詳細にわたるマウスの行動観察記録は、その後、実中研が人工飼料の生産を手掛ける上で、貴重な基礎データとなった。 ところでマウスが引っ越した後、増子と美智子は大磯でいろんな実験動物の開発を試みている。 7年の歳月をかけて二人が実験動物化に成功したスナネズミもその一例で、これはやがて米国や欧州で人気の高い実験動物となる。

| 年代 | 事項 |
|---|---|
| 1956年 | 米軍第406医学総合研究所と契約締結 年間供給量:マウス60,000匹、固形飼料12,000kg |
| 1957年 | 文部省直管財団法人として認可 米軍上記研究所が契約打ち切り サルモネラ症大発生 |
| 1958年 | マウスの種親保持のため、達次の自宅に飼育舎建設 青山支所開設 |
| 1959年 | 目黒支所開設 大泉支所(群馬県大泉町)開設 サルモネラ症の根絶が不可能なため、西多摩郡瑞穂町の全コロニーを処分 同施設全廃・閉鎖 大泉支所の飼育施設焼失のため、ウィスター系ラットの生産中止 |
| 1961年 | 目黒に最初のSPF動物施設完成 |
| 1962年 | 川崎市野川にSPF動物生産施設完成
SPFマウスの種親を米国より輸入 野川でSPFマウスの生産開始 |
達次の研究室の長で恩師でもある安東博士は、かねてより実験動物のレベルを上げることの重要性を説いていた。
折しも1953年、野村家秘蔵のシルバー種のハムスターが飼育の不慣れから瑞穂町で全滅してしまう。
そして達次は医学研究者の道を選ぶか、それとも実験動物を育てる飼育者の道を選ぶか、安東博士からのかつての問いかけに答えなければならない、その決断の時を迎える。
1954年、安東研究室を離れた達次は一人の実験動物生産業者となり、実中研が作り出したマウスを売り歩くことになる。
だが訪問先では「動物屋さんは裏口に回って」とあしらわれ、かつての研究者仲間も「あれは野村の道楽だ」とか、「あいつは研究者の道を捨て、金儲けに走った」と陰口をたたいた。
しかし米軍の第406医学総合研究所だけは様子が違った。
達次が持ち込んだ良質なモルモットを「プラチナ級」と手放しに喜び、ついには1955年に年間6万匹のマウスと12トンの固形飼料、当時の為替レートで720万円にものぼる大量発注をしてくれる。


米軍施設の大量発注を受けた瑞穂町の実中研では、飼育舎の増設を含めた各施設の改善が進み、地元の銀行も初めて無担保で金を貸してくれた。
こうした追い風を受けて、実中研を法人化しようという動きが出てくる。 1957年8月6日に実中研はついに文部省直管の財団法人となる。
だがその資本約559万円の殆どは、駿吉(達次の父)と松方亮三(達次の弟)からすでに貸与され、瑞穂町で稼働していた土地建物で、あとは友人からの寄附金により成立したつつましい法人組織であった。
そして代表理事には安東洪次教授が、常任理事には野村達次が就任した。
ところが実中研が財団法人になったのとほぼ同時に、第406医学総合研究所の契約が突然打ち切られる。
さらに2ヶ月後の1957年10月には、外部から持ち込まれたサルモネラ菌が瞬く間にマウス飼育舎に広がり、1958年10月に6,000匹、翌1959年9月にはさらに5,000匹のマウスを殺処分せざるを得なくなる。
それでも感染は食い止められず、瑞穂町の施設は間もなく全廃・閉鎖に追い込まれる。
わずかに救い出された健康な種親は隔離され、達次が『最後の牙城』と覚悟して青山の自宅に建てた建坪7.5坪ばかりの飼育舎に緊急避難させた。
同時にマウスを量産するための新たな場所探しが始まり、1959年7月に群馬県大泉町に新しい飼育舎が建てられた。
一方のラットもサルモネラ感染を避けるため、飼育舎の完成と同時に大泉町に送られる。 だがその年の12月、今度は大泉町のラットの飼育舎一棟が火災で焼失する。
実験動物の飼育販売どころでなく、実中研の存続さえ危ぶまれた窮状を救ったのが、固形飼料である。 法人化された1957年以降、固形飼料の製造販売は順調に伸び、当初の供給量が月産5トンだったのに対し、1960年には月産8トンを超すまでになっている。 また販売収入についても実験動物が1957年に228万円だったのに対し、固形飼料は347万円あり、その後も固形飼料の販売収入が実験動物の販売収入を大きくリードする時代が続く。


1958年にパリで開かれた第一回国際実験動物会議に出席した安東博士は、SPF動物(Specific Pathogen-Free
Animals)の本格的な生産が、米英連携で始まろうとしていることを知り、実中研でもSPF動物の実現と供給を目指そうと考える。
しかしそのためには、ある程度まとまった資金を投入して、厳重に衛生管理を行える施設を建設する必要がある。ところが当時の実中研には金がなかった。
そんな折、米国国立衛生研究所(NIH: National Institutes of
Health)が資金援助を申し出てくれ、1959年から向こう4ヵ年で合計4,270万円の援助をしてくれることになる。
実中研は国内でも科学技術庁に働きかけ、1962年までに合計3,012万円の補助を受けられるようになる。
さらに財界に対しては総額1億円を目標とした寄附金の募集を行った。だがこちらは1964年の時点になっても8,180万円しか募金が集まらなかった。
1960年から1965年まで足掛け5年の歳月と1.9億円の資金を費やした新施設の建設プロジェクトが動き出す。
用地は2ヵ所。一つは当時本部があった東京目黒区の100坪(約326平方メートル)の土地と、もう一つは新しく購入した川崎市野川の1,130坪(約3,730平方メートル)の土地である。
1961年6月、最初のSPF動物施設が目黒に完成する。 鉄筋コンクリートの2階建て、円形の斬新なデザインで、2階部分の右側が滅菌・消毒エリア、左側が無菌エリアからなり、総床面積は118坪(約390平方メートル)におよんだ。 無菌室(バリア室)は、微生物の侵入を完全にシャットアウトし、送り込まれる空気も滅菌された。 さらに室内で作業する人間や、中に持ち込まれる器具・水・飼料なども、搬入前にすべて消毒・滅菌され、この無菌室の中に置かれたビニール・アイソレータ(無菌飼育装置)の中で無菌マウスを飼育する。 ここで人工飼育された仔マウスは、ある程度成長したところでSPF環境のビニール・アイソレータに移され、特定の細菌が人工的に定着させられ、SPFマウスになったのである。
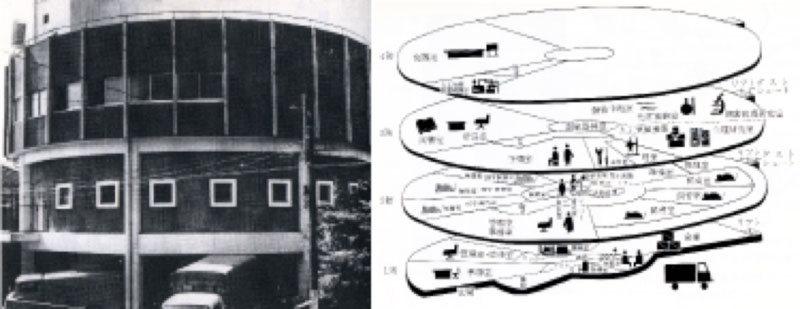

1962年5月に川崎市野川に完成したSPF動物生産施設では、SPFマウスの生産と飼育を目指した。
ところがこちらは難航する。というのも出生時の体重がわずか1.5グラムほどの仔マウスを、うまく母マウスの子宮から摘出して蘇生できなかったからである。
種親がいなければSPFマウスの生産体制は確立できない。そこで急きょ、種親となる無菌マウスが40匹ほど米国から輸入され生産体制が確立された。
無菌動物の開発については、マウスよりも大型なラットは、ずっと扱いやすいため人工哺育に成功し、マウスより一足先に無菌飼育技術が確立している。
| 年代 | 事項 |
|---|---|
| 1963年 | SPFマウス供給開始 秩父宮妃殿下、野川支所ご見学 |
| 1964年 | SPF動物の飼料・環境統御および微生物検査法を確立 SPFマウス月産2万匹達成 SPFラット供給開始 安東洪次理事長、紫綬褒章授章 固形飼料月産60トン達成 |
| 1965年 | 生産供給部門を日本クレア株式会社として分離独立 野村達次、第1回小嶋三郎記念賞受賞 |
| 1965年~1970年 | 米国アーマー社との共同研究 |
| 1966年 | 無菌動物の繁殖・飼育成功 医学研究部門設立 米国NIH-ミシガン大学との共同研究 |
実験動物と固形飼料の生産販売が軌道に乗る1963年頃から、実中研の研究開発活動は一段と活発になる。 そして1966年には医学研究部門を設立し、ヒトの医学発展に貢献する前臨床研究分野で様々な研究活動を展開するまでに発展する。
野川のSPF動物生産施設の完成により実験動物と固形飼料の生産量が飛躍的に拡大し、 1963年の供給量はマウス15万匹、ラット12万匹、固形飼料が410トン、翌1964年の供給量はそれぞれ25万匹、15万匹、543トンに達している。 同時に実中研の財政状態も大幅に改善し、1964年には1.8億円の収入を計上。 うち収益部門が1.4億円を、非営利部門の収益が約3,600万円に達し、剰余金の合計金額は700万円近くになった。 しかし、財団法人は本来非営利の公益法人でなくてはならない。そこで実中研の本体事業から収益事業が切り離され、1965年2月に日本クレア社が設立される。 なおクレアという名は、当時の実中研の英語名:Central Laboratories for Experimental Animalsの頭文字を組み合わせて作られた。


1960年代後半に実中研が飛躍的に発展した背景には、皮肉にもサリドマイド事件という痛ましい社会問題があった。 サリドマイドは1957年に西ドイツの製薬会社から発売された催眠剤で、妊娠初期に服用した妊婦から腕のない奇形児が多く生まれた。 日本では1958年から1962年にかけて販売され、約300人のサリドマイド児が生まれている。 このサリドマイド薬禍により、薬害が本人だけに留まらず胎児にまでおよぶ可能性があることが、明らかとなった。 そのため厚生省は1964年4月、新薬の許認可申請を行う場合、適切な動物実験を行ったことを証明する資料の提示を義務付けた。 それに呼応した製薬会社は各社一斉に自前の動物実験施設を整え、高品質の実験動物を大量に求めたため、使用数が飛躍的に伸びたのである。

実中研の発展とともに、本格的な研究体制を整えようとする動きが出てくる。 そこで米国ミシガン大学で薬物依存と精神薬理を学び、「薬物への依存性」を測定できる装置を開発して世界的な注目を浴びていた柳田知司博士を迎え入れ、1966年に医学研究部門を設立する。 柳田博士は米国NIHとミシガン大学との共同研究や海外の製薬会社等からの委託研究、さらに世界保健機構(WHO)との長期共同研究も積極的に進める。 そして1968年に研究棟が野川に建設されると、医学研究部門は一層独立性の高い医学研究所となり、翌1969年からは生殖生理学、薬理学、精神薬理学、病理毒性学、臨床薬理学の5部門で、研究活動に取り組むようになる。 ただし実中研が注力するエリアは、ヒトそのものを対象とする「臨床研究」ではなく、あくまでも臨床研究の前段階において実験動物を使って行うヒトの疾病の研究、すなわち「前臨床研究」である。 こうした基本的なスタンスは、今日に至るまで一貫して守られている。
実中研はサル類を研究テーマとして1966年に米国フォード財団に資金援助を申請し、1967年から向こう10年間で総額10万ドルもの支援を受けている。 そして1972年秋からスタートした第二次契約ではニホンザルの実験動物化が予定され、鹿児島県奄美大島沖の枝手久島という無人島に人間や他の動物から隔離したコロニー建設することを計画した。 しかしここが観光開発の対象となり、さらに石油精製基地候補となったため、この計画は一旦中断する。 フォード財団との契約終了後も、実中研は中型ザルや小型ザルに関する自主研究を継続したが、国内は人件費も含めた物価水準が高く、生産コストがどうしても高くついた。 そのためインドネシアの無人島でカニクイザルの人工繁殖がスタートする1988年まで、マカクサル類の実験動物化の動きは停滞する。 なお、コモンマーモセットの開発は1970年代に始まり、継続している。
| 年代 | 事項 |
|---|---|
| 1967年 | 実中研の英語名称をCLEAからCIEA(Central Institute for Experimental Animals)に変更 安東洪次名誉所長、勲三等瑞宝章授章 米国フォード財団からの研究費支給開始(10年間で総額10万ドル) |
| 1969年 | 疾患モデル動物の研究開発を開始 ICLA国際実験動物アジア太平洋会議事務局設置 川崎市野川にノトバイオート研究施設完成 |
| 1970年 | 日本EDM(株)設立 スイスのチバ・ガイギ社との共同研究 米国シェリング社との共同研究 WHOとの共同研究 |
| 1971年 | 野村達次、ICLA日本代表に就任 |
| 1972年 | 野村達次、日本癌学会評議員に就任 野村達次、ICLA財務理事に就任 田嶋嘉雄学術顧問、紫綬褒章授章 斎藤宗雄技術研究員、毎日工業技術奨励賞受賞 |
| 1973年 | バイオサイエンス研究部門を設置 |
| 1974年 | 川崎市野川に微生物棟完成 ナキウサギの実験動物化開始 |
| 1975年 | 野川の研究施設棟完成に伴い、全部門をここに集結 ヌードマウスにおいて白血球増多現象を世界で初めて観察 野村達次、日本医師会最高優功賞受賞 ヌードマウス通算1万匹生産達成 |
| 1976年 | 「The 2nd International Workshop on Nude Mice」東京にて開催 会長:野村達次 |
| 1977年 | 明仁皇太子ご来所 |
| 1979年 | ICLASモニタリングセンターに指定 |
| 1981年 | 実中研維持会員制度発足(製薬会社など34社) |
| 1982年 | 発生工学研究室新設 |
| 1984年 | 江崎孝三郎主任研究員、科学技術庁長官賞受賞
野村達次、紫綬褒章授章 |
| 1985年 | 実験動物モニタリング棟完成 |
1970年代初頭、今までの研究開発ノウハウの蓄積を生かし様々なSPF動物が作出されるようになると、今度はその品質をいかに維持継続していくかが重要課題となる。
ICLASモニタリングセンターの設立は、そうした課題に応じる一つの動きだった。
さらに1970年代後半以降、実中研はヒトと極めてよく似た生理機能・機構を持つ生理的モデル動物や、ヒトの病気と同様の病気を持った疾患モデル動物の研究開発にも、積極的に取り組んでいる。
なおG-CSF(Granulocyte Colony Stimulating
Factor)は、ヒトがんの研究のためヌードマウスを研究開発していた過程で、患者がん組織を移植したヌードマウスから1975年に実中研が世界で初めて発見した白血球を増殖させる因子である。
一方、実中研では1960年代後半から疾患モデル動物の研究開発を始めていたが、実験動物の開発•改良の新技術としての実用化を目指して、当時は黎明期にあった発生工学にいち早く着目し、
1982年に勝木元也博士(慶應義塾大学医学部)を迎い入れて発生工学研究室(兼任)を新設した。

ノトバイオートは保有している微生物がすべて明らかで、微生物の働きを解明できるという特徴がある。
その他にもヒトの疾病研究に役立ついくつかの特異性があるため、1960年以降、新たなタイプの実験動物として俄然注目を浴びるようになる。
だが当時、ノトバイオートを供給できるところは、米国のチャールズ・リバー社しかなかった。さらにノトバイオートの元となる無菌動物を供給できるところも、世界的に見て非常に限られていた。
そしていずれも高価で輸入費がかさむため、日本ではほとんど使えない状態だった。
一方、実中研ではかつて無菌マウスの種親の準備に失敗し、輸入に頼らざるを得なかったという経緯から、どうしても無菌動物を自己量産したいと思っていた。
こうした背景から実中研は1969年、無菌マウスと無菌ラット、およびノトバイオートの生産技術の開発に本格的に取りかかり、
1972年には無菌マウスを月産300匹、ノトバイオートマウスを700匹、ノトバイオートラットも200匹ほど量産できる体制を確立する。
同時に、ノトバイオートの検査方法から輸送方法に至る一貫したシステムも開発する。その研究成果は社会的にも高く評価され、1972年に齋藤宗雄が毎日工業技術奨励賞を受賞している。

実験動物の遺伝的な均質性は、20代以上の近親交配を繰り返す近交系や、数十匹の動物を他から完全に隔離して飼育・繁殖させるクローズド・コロニーという方法が確立されてきた。 近交系は維持が容易であるが、系統毎に反応性が異なる場合があり、クローズドコロニーでは維持の過程で遺伝的偏りが起きやすいことが考えられる。 これらの難点を克服するため、実中研の江崎孝三郎、吉村幸夫らは1976年、クローズド・コロニーであるICRマウスから複数の近交系を樹立、そこから4系統を交配することで、 均質性のある交雑系の動物、すなわちハイブリッド系統を誕生させる研究に着手した。 そして1984年にはMCH(Multi-Cross Hybrid)マウスの量産を実現させ、1985年にはそれらを日本クレア社から市販するに至る。

1970年代後半になると、実験動物の長期的な品質管理が必要だという考え方がでてくる。 実中研は1978年に文部省の補助を受けて日本初の実験動物のモニタリング検査を実施し1)遺伝的形質、2)微生物的品質、および3)モニタリングデータのコンピューター化の手法を模索した。 これと前後して、検査によって保証する実験動物の品質検査項目は、国際的な共通基準として定めるべきではないかと、実中研は米国の国立衛生研究所(NIH)に提案している。 この提案に応じた国際実験動物学会議(ICLAS:International Council for Laboratory Animal Science)は、1979年にグローバル・スタンダードの検査を行うモニタリングセンターを、世界各地に設置するべきだという勧告を発する。 そしてこの勧告に応じた実中研は、目標額2億円の新たな募金活動を1981年にスタートさせ、1986年に世界初のICLASモニタリングセンターを構内に誕生させる。
生理的モデル動物は、ヒトと極めてよく似た生理機能や生理機構を持っているため、ヒトの「モデル」として使用できる。 そしてモデル動物を系統的になるべく幅広い動物種で開発すれば、薬物等の安全性評価を広汎に行える。こうした考えに基づき、1970年代後半になると、 実中研はゲッチンゲン・ミニブタ(通称ミニブタG)、ナキウサギ、メキシコウサギ、スンクス(ジャコウネズミ)等、実にいろいろな動物の研究開発を手掛けるようになる。
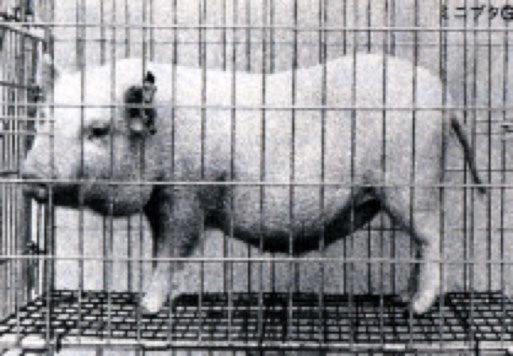
ブタに関しては、交雑関係や感染状況、取扱いやすさ等を考慮して、通常のブタ(平均300キログラム)よりはるかに小さいゲッチンゲン・ミニブタ(20~60キログラム)の実験動物化を1975年から開始した。
メス8頭とオス2頭からスタートさせたこのプロジェクトは、やがて文部省や通産省の援助を受けながら東レ(株)とも共同研究を重ね、1980年にはSPF動物化、さらに1982年には百数十頭の遺伝的均質性を持つクローズド・コロニーの形成に成功している。

1984年、やはり世界に先駆けて実中研が実験動物化に成功したナキウサギは、通常使用されるカイウサギの4.5キログラムと比べて平均体重が300グラムと、はるかに小さく軽い。 このため取扱いやすく、飼育管理に必要なスペースも小さく、飼料も少なく、値段が安くて済むという様々な経済的なメリットがある実験動物である。 このアフガニスタン由来のナキウサギをフランスから導入し、催奇形性試験における有用性を検討した。

一方、ウサギ類の実験動物化の一環として1985年に実中研が世界で初めて人工繁殖に成功したメキシコ原産のメキシコウサギは、絶滅危惧動物の保護育成に取り組むイギリスのジャージー財団の要請に応じて1987年に雌雄2対を寄贈する。 こうしてメキシコウサギを人工繁殖させメキシコの原野に再び戻すという、同財団の遠大なプロジェクトにも貢献している。

さらに船酔い現象を起こすモグラの仲間のスンクスも実験動物化しているが、こちらは宇宙飛行士の宇宙酔い現象や薬物投与によって引き起こされることがある嘔吐現象の研究に使用されている。
1960年末頃から、ヒトの特定の病気を研究するには、同様の病気を持った動物モデルを使用して実験を行った方が良いのではないかという概念が出てくる。実中研はそうした考え方に呼応した疾患モデル動物の研究開発にも取り組んでいる。
筋ジストロフィーは、特定の遺伝子の欠損によって起こる筋委縮症で、病気が進行すると心臓麻痺を起こし、ついには死に至る。 この難病の原因究明と治療法を探るため、厚生省は1968年に筋ジストロフィーの特別研究班(座長:沖中重雄 東京大学医学部教授)を立ち上げる。 研究班のメンバーとなった野村達次には、自然突然変異種である筋ジストロフィー・マウス(C57BL/6-dy/dy)を実験動物として量産・飼育することが求められ、1970年に月産50匹を供給できる体制を整える。 これが実中研が初めて手掛けた疾患モデル動物である。 さらに2年後の1972年には筋ジストロフィー・マウスのSPF化に着手し、1983年にこれを実現している。 このプロジェクトが継続された20年間に、筋ジストロフィー・チキンや筋ジストロフィー・ハムスターなども開発供与したが、最終的にヒトの筋委縮と他の動物の筋委縮とは発症のメカニズムが大きく違うことが判明した。 その後、英国でヒト筋ジストロフィーと同じメカニズムで発症する突然変異マウス(C57BL/10-mdx/mdx)が発見され、実中研では1983年にこれを導入して生産体制を整えて供給を続けている。

ヌードマウスは自然突然変異種の免疫不全マウスで、1962年に英国で発見された。
このマウスには胸腺がないため、通常の飼育では発育が悪く、繁殖能力も低くて短命だった。
ところが胸腺がないために、外から侵入してくる異物を排除する免疫機能が弱く、ヒトのがんを容易に移植できることが、1969年に明らかになる。
こうした医学研究上のメリットに着目した実中研は、ヌードマウスの計画量産・飼育の研究に1973年から取り組み、翌1974年に月産300匹、1975年には年産
15,000匹の生産体制を整え、1976年には生産方式を確立した。
同時にヌードマウスを用いた高度な組織の移植技術も編み出し、一度に何百匹ものヌードマウスを使用したヒトがんの研究や抗がん剤の効果測定等が行えるようになる。
すなわち、ヌードマウスに様々なヒトがんを体系的に移植し、増殖定着化(株化)させ、株化したがん組織を再び切除して凍結保存した後、これを解凍し、再び別のヌードマウスに移植するという一連のプロセスからなる方式だ。
そして実中研は400以上の異なるがん組織を凍結保存し、いわばがんのミニチュア専門病院のような貴重な施設を保持するようになるのである。
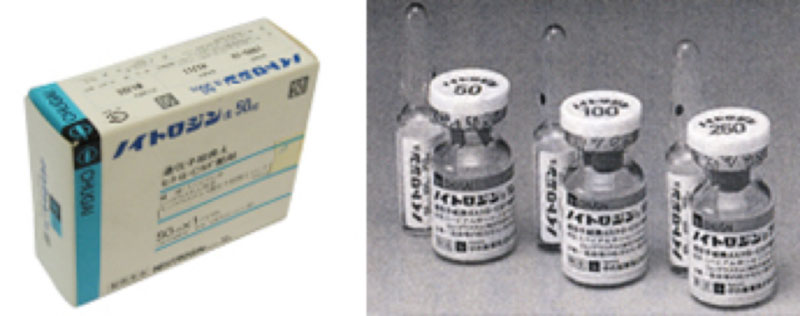
実中研の上山義人らと東海大学医学部、東京大学医学部の研究スタッフは、ヌードマウスに取り組んでいた1975年に、白血球が突然、異常なほど増える白血球増多現象、 つまりヒトがんの組織が白血球を増殖させるG-CSF因子を作り出す現場を、世界で初めて観察する。 このG-CSF因子を特定できれば白血球減少症を治療する薬も開発できることから1985年に中外製薬と提携し、研究をすすめる。 そしてついに1991年、白血球減少症を治療する「ノイトロジン」という薬が、中外製薬から世界に向けて発売されるようになる。
| 年代 | 事項 |
|---|---|
| 1986年 | ICLASモニタリングセンター棟稼働 |
| 1987年 | 常陸宮・同妃殿下、ご来所 文部省重点領域研究「遺伝子導入動物(6年間)」開始 「発生工学実験マニュアル・トランスジェニックマウスの作り方」出版 |
| 1988年 | 野村達次、ICLAS総会シンポジウムにおいてミュールボック記念賞受賞 ICLAS名誉会員就任 文部省特定奨励「実験動物モニタリング事業」開始 第29回国際産業映画・ビデオ祭国内大会、第1回日本産業映像祭において「生命のプログラミングⅡ」が科学技術長官賞受賞 |
| 1989年 | 第30回科学技術映画祭において「生命のプログラミングI」と「生命のプログラミングII」が奨励賞受賞 (株)前臨床医学研究所設立 イタリア国際映画祭において「生命のプログラミングII」が金賞受賞 |
| 1990年 | アメリカのジョン•ミューア医学映画祭において「生命のプログラミングⅠ」が科学部門の金賞受賞 |
| 1991年 | ポリオマウス実験動物化を開始 所史「六匹のマウスから」出版 中外製薬と共同研究してきたヌードマウスの白血球増多現象をもとに、白血球減少症治療薬のノイトロジンを世界市場に上市 |
| 1992年 | 実験動物凍結保存施設完成 |
| 1993年 | WHOがポリオマウスをポリオ根絶に活用することを決定 |
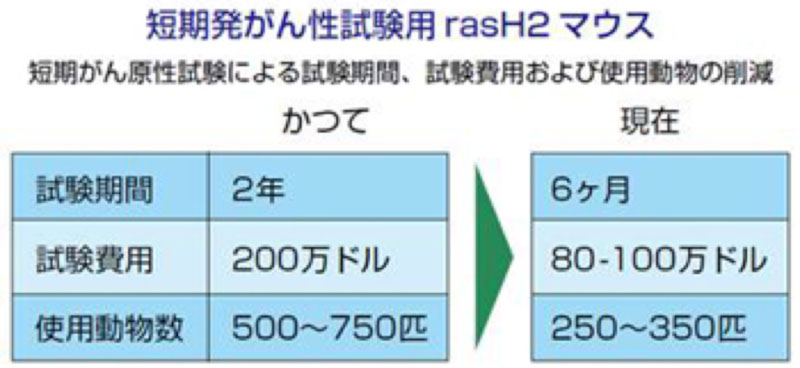
| 1995年 | ICH世界大会においてrasH2マウスを発表 新薬の発がん性評価試験の必要期間短縮と結果判定の簡便化に貢献 |
| 2001年 | 米国NPO法人CAHB設立 |
| 2002年 | 海外事業展開開始 『究極の免疫不全マウス』と評されるNOGマウスの作出 |
| 2005年 | NOGマウス特許取得 |
| 2006年 | 野村達次所長、理事長に就任 「The 1st International Workshop on "Humanized Mice"」東京にて開催。会長:野村達次 |
| 2010年 | 脊髄損傷や心筋梗塞の再生治療に直結するマーモセットの世界一のクローズド・コロニーを、日本クレア社で維持 |
| 2011年 | 公益財団法人に認定 川崎市川崎区殿町に新研究所を開設 |
1980年代に入ると発生工学と呼ばれる新しい研究領域と方法論が誕生するが、実中研はここでも大きな役割を果たすことになる。 すなわち、1987年から文部省「重点領域研究•遺伝子導入動物」が6年間という異例な長期の研究期間で実施されることになり、野村達次が領域代表者を、勝木元也博士が実務と事務局を担当することになる。 研究組織は、総括班(20名)と3班(森脇班、勝木班、野村班)から構成され、延べ人数で80名余りの研究者が携わるオールジャパン体制であった。 この研究班は、わが国の遺伝子改変動物の研究基盤を確立するのに大きな貢献を果たすことになった。 この研究班からはいくつもの大きな成果が生まれたが、実中研関連ではアンチセンスによるミエリン形成不全マウス、高血圧マウス、がん遺伝子導入マウス(発がん性試験用rasH2マウス)など、 また実中研外の班員からは、アミロイドーシスマウス(熊本大学)、ポリオウイルス受容体導入マウス(東京都臨床医学総合研究所)など、生物機能やヒト疾患のモデルとなるマウスが作り出された。 また、体外受精や胚•配偶子の凍結保存、胚の卵管移植、卵巣移植など、それまで行われていた手法を全面的に見直した結果、革新的な動物実験システムが確立された。 こうした分子生物学上の快挙は、人為的な遺伝子操作を施したマウスの研究開発に弾みをつけ、小児麻痺の生ワクチンの安全性評価に役立つポリオマウス、新薬の発がん性評価の新たな試験法を確立したrasH2マウス、 さらに免疫機能がほとんど働かず、エイズや白血病の研究に役立つNOGマウスの開発、といった世界的な成果を生み出すに至る。 さらに近年は脊髄損傷や心筋梗塞の再生医療に光明をあてた小型サルのコモンマーモセットの実験動物化や、実験動物の国際標準化を目指したGALASという連携プロジェクトの一員としても、グローバルな展開を推進している。
こうして実中研は、高品質で均質な実験動物を医療の場に提供すると同時に、実験動物を使ってヒトの疾病を研究する前臨床研究分野においても、世界トップの研究開発機関としての足場を着実に固めていった。 そして様々な病気の原因を解明し、医療を発展させ、人々の健康と福祉を向上させたいという基本姿勢を大切に、今も新たな地平を拓き続けているのである。
◯ポリオマウス
実中研が1991年から1999年頃にかけて精力的に取り組んだのが、ポリオマウスの実験動物化と、それを使った小児麻痺生ワクチンの安全性を評価・確認する検定方法の確立である。
小児麻痺(ポリオ)は、四肢が動かなくなるような重い後遺症を残す。そしてその予防接種には、弱毒化させたポリオウィルスで作られる生ワクチンが使用される。
だが弱毒化が不十分だとワクチン自体がポリオの感染源になってしまうため、安全性の確認は不可欠である。 従来、この生ワクチンの安全性を確認するのにサルを使っていた。
しかし検定感度やサル個体数の減少、動物保護の観点から、サルにとって代わる実験動物が求められるようになってきた。
東京都臨床医学総合研究所の野本明男博士らは、1991年にヒトのポリオウイルス受容体遺伝子を導入した遺伝子導入マウスを作り出すことに成功していた。
このマウスを野本博士から引き継いだ実中研が実験動物化を行い、さらに日本ポリオ研究所、米国NIH、WHOと共同研究として取り組んだのが、ポリオマウスを用いた小児麻痺ワクチンの安全性検定法の確立である。

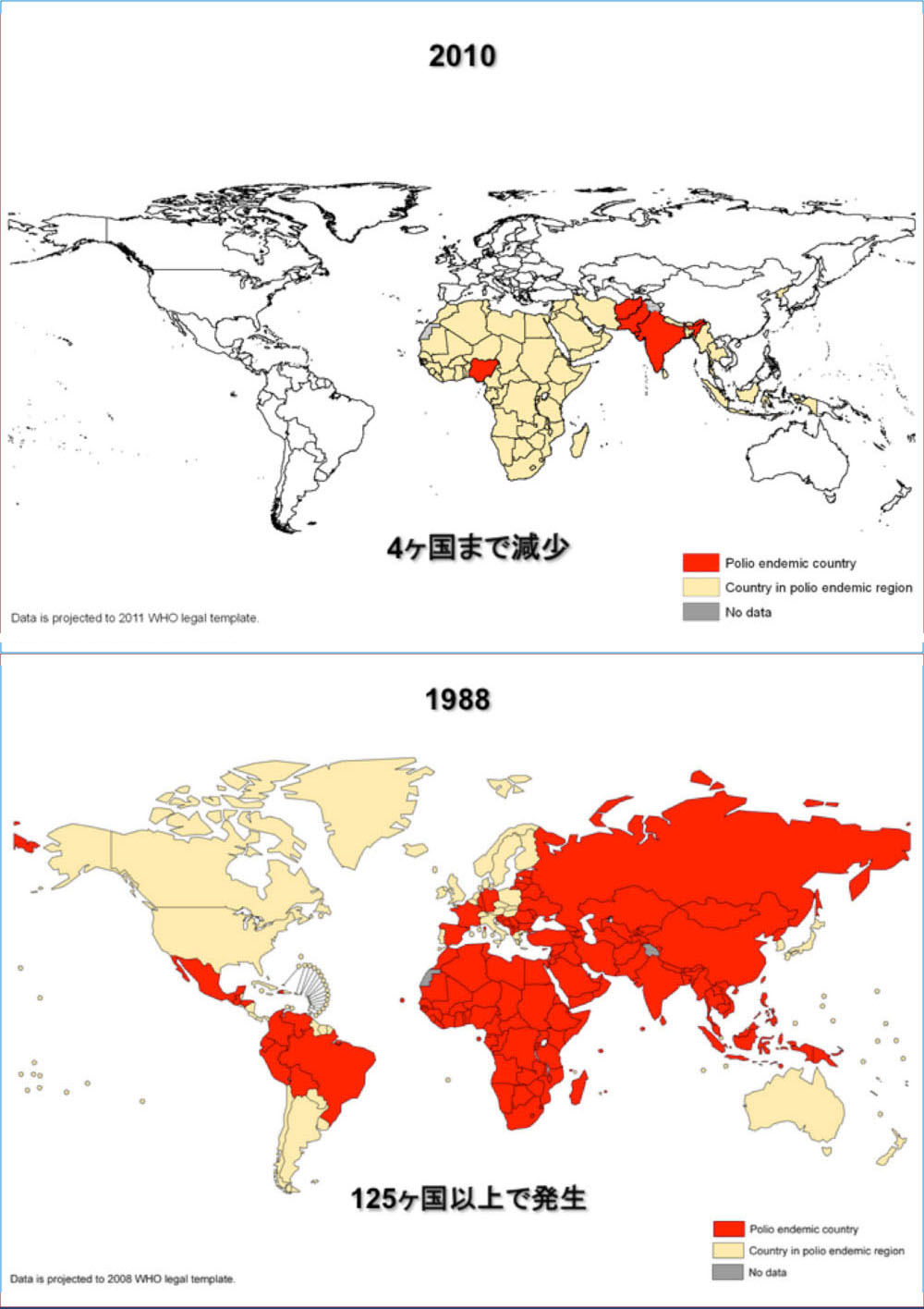
ちなみに1993年、WHOが主導して行われたポリオマウスとサルを使った生ワクチンの安全性評価法に関する比較テストでは、ポリオマウスの方が正確度と経済性に優れていると判断された。 さらに貴重な霊長類であるサルをマウスに代替させたことも高く評価された。このため小児麻痺の生ワクチンの安全性を評価・確認する際、従来のサルの使用からポリオマウス使用への移行が、1990年代中ごろからグローバルレベルで急速に進んだ。
◯rasH2マウス
rasH2マウスは、ヒトのがん遺伝子の一つであるrasが組込まれた遺伝子導入マウスで、重点領域研究の成果の一つとして、
実中研と東海大学医学部の勝木元也教授(実中研を兼務)、木村穣博士ら、国立がんセンター研究所関谷剛男博士らとの共同研究によって1989年に作り出されたものである。
実中研はこの遺伝子導入マウスを引き継ぎ、1992年から実験動物化を行った。
その開発には新薬開発の際に必ず行われる「安全性評価試験」のうち、特に「発がん性評価試験」が念頭にあった。
というのも従来の評価試験では、新薬に含まれる化学物質を正常なマウスやラットに投与し続けて、がんが発生するかどうかを2年以上観察しなければならず、膨大な時間と費用がかかった。
さらにがんが発生した場合でも、それはネズミのがんであってヒトのがんではないため、ヒトに投与した際、同じようにがんを発症させるのかどうかの判定が極めて難しかった。
このような問題点は長年議論されていたが、目覚ましい解決方法はなかった。 だから実中研が1995年の第3回ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use:医薬品承認審査ハーモナイゼーション国際会議:新薬開発の審査・承認に当たって国際的な共通ガイドラインの制定を促進する場) の世界大会でrasH2マウスの研究成果を発表した時、一大センセーションが巻き起こる。 rasH2マウスの出現で今までの問題点が解決され、新薬の「発がん性評価試験」の結果判定が容易になり、必要な試験期間も従来の2年以上からわずか6ヵ月へと大幅に短縮されることが示されたからである。 これがきっかけとなって、ICHも発がん性評価の試験方法を国際的な見地から全面的に見直すことになる。
その後、p53マウス、TgACマウス、XPAマウスといった遺伝子操作マウスも、米国や欧州の各研究機関から次々と発表された。 だが日米欧の新薬承認に携わる各行政機関(厚労省、米国FDA、欧州CPMP)の4種のマウスの比較試験は、rasH2マウスに最高の評価を与えている。 このためrasH2マウスの需要が2010年には全世界で23,000匹に到達し、FDA主導の米国においてさえ、rasH2マウスが主流になりつつある。
◯NOGマウス
NOGマウスは、マウスが持っている正常な免疫機能を、人為的な操作により限りなく少なくなるよう排除した超免疫不全マウスで、これは実中研の伊藤守チームが世界で初めて作り出したものである。
自然突然変異種の免疫不全マウスには、1962年に英国で発見されたヌードマウスがある。これは胸腺を欠くため、胸腺由来のT細胞がないことが免疫不全の原因となっている。
その後1983年に米国で発見されたSCID(Severe Combined
ImmunoDeficiency:重症の複合免疫不全症)マウスも自然突然変異種の免疫不全マウスだが、こちらはT細胞だけでなく骨髄由来のB細胞もない。
このため、ヌードマウスよりさらに複合的で重度な免疫不全に陥っており、ヒトのリンパ球も移植できることが大きな特色だ。
そしてこの特色に着目して、リンパ球に感染・増殖し、伝播するヒトエイズ疾患(HIV)の研究に使用され、SCIDマウスは世界的な注目を浴びるようになる。
実中研ではこのSCIDマウスの種親を1985年に米国から導入し、免疫機能が全くないマウスを人為的に作り出す研究に取り掛かる。
その研究プロセスにおいて伊藤守チームは、NOD(Non-Obese
Diabetic:痩せ型糖尿病)マウスとの掛け合わせが、さらに重度な免疫不全を起こすことを発見する。だがNOD/SCIDマウスにはまだ、免疫機能をつかさどるNK細胞がかなり残っていた。
一方、1995年頃になると遺伝子操作技術の飛躍的な進歩により、マウスが備えている正常な免疫機能を、遺伝子ノックアウト技法によって人為的に潰してしまうことが可能になる。 さらにどの遺伝子をノックアウトすれば免疫機能が限りなくゼロに近くなるかもわかってくる。 東北大学医学部の菅村和夫博士のグループがこの手法を利用して、NK細胞を欠損した遺伝子操作マウスを作出していた。ところがこちらはT細胞とB細胞がかなり残っていた。
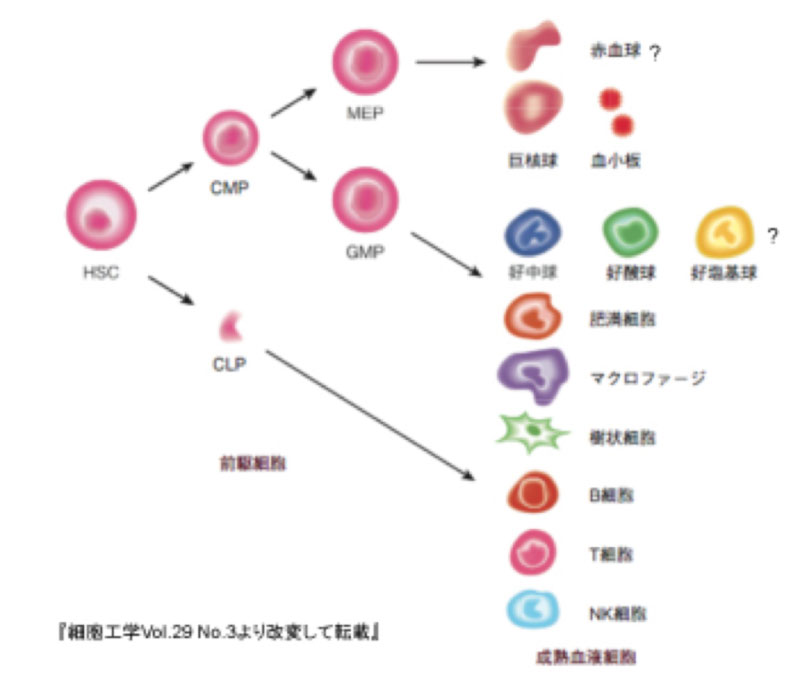
こうした状況下、菅村グループで東北大学から東京医科歯科大学に移っていた中村正孝博士が伊藤守チームにそのIL-2RγKOマウスの提供を申し出た。 NOD/SCIDマウスとIL-2RγKOマウスを複合化すれば、より完全な免疫不全マウスが作り出せるのではないかと。 その結果、ヒトの造血幹細胞の生着率が40~70パーセントという驚異の結果を示す「究極の免疫不全マウス」のNOGマウスが産み出された。 その後、このNOGマウスを使って様々なヒト化マウスが作り出されるようになった。 そして実中研では、すでに2006年には約10,000匹のNOGマウスの計画生産体制を確立していた。


◯コモンマーモセット
実中研がヒトに近いサル類の実験動物化に取り組み始めたのは、1960年代のことである。
そして南米原産のマーモセットを最初に手掛けたのは1973年だった。だが17匹の野生種を輸入した当時、餌のこともよくわからず、1ヵ月もたたないうちに全滅してしまった。
その後1983年に英国ICI(Imperial Chemical Industries)から60匹を導入、それが実中研のコロニーのおおもとになっている。
それからほぼ10年かけて実験動物化に成功したものの、日本人にとってあまり馴染みがないサルだったため、長い間使われることがなかった。
しかしマーモセットは他のサル類と比べて格段に小さく、体重が200グラムから400グラムしかない。これはおよそラットと同じくらいで、扱いやすいサイズだ。
加えて他のサルと違って多産で、一回の出産で2~3匹、1年に2度出産するため、1匹のメスから10年間でだいたい50匹の仔が生れる。
こうした利点が着目され、2000年以降、再生医療分野で積極的に使われ出す。
現在、マーモセットが実験動物として積極的に使われているのは、脊髄損傷と心筋梗塞の再生治療の研究分野である。 脊髄損傷の再生治療に関しては、交通事故などで脊髄の神経にダメージを受け、下半身が麻痺したヒトの機能を回復・再生させるため、幹細胞を移植する治療法の開発に使われている。 一方、心筋梗塞の再生治療に関しては、梗塞によって損傷したヒトの心筋を、ヒトの新しい心筋細胞を移植することで再生させることを、最終目標としている。 なお実中研の関連会社の日本クレア社では、2010年時点で雌雄各500匹からなる世界一のマーモセットのクローズド・コロニーを維持している。

◯GALAS
(Global Alliance for Laboratory Animal Standardization)
GALASは世界各国の動物生産企業が同盟を結成して、実験用動物の標準化を進めていこうということで、1998年秋に提唱された。
同年、日・米・欧の4社の実験動物生産企業と実中研が組んで、まず安全性評価試験に用いられるラットに関する標準化を進めるための契約が締結され、
最初にウィスター・ハノーバー系統のラットの規格化と標準化を目指すこととなった。
さらに実中研は、今後はラットだけでなくマーモセットも含めた様々な実験用動物の国際的な標準化を、GALAS方式で展開していく意向である。

そして、2011年夏、羽田空港に隣接する川崎市の臨海部に新たな研究施設を開設した実中研は、製薬企業や医療機器関連企業、 さらに健康・食品関連企業やベンチャービジネス等とともに基礎研究と応用に励み、医療・創薬の基盤技術をベースにした新たな産業基盤技術の形成に積極的に取り組んでいく。
| 年代 | 事項 |
|---|---|
| 2011年 | 公益財団法人に認定 殿町(川崎市川崎区)に新研究所を開設 国際戦略総合特区「京浜臨海部ライフイノベーション国際戦略総合特区」に指定 |
| 2012年 | 日本マーモセット研究会発足・事務局:実中研 ヒューマンサイエンス(HS)振興財団による外部検証「適合」評価取得 |
| 2013年 | 野村達次所長・理事長逝去 野村龍太が理事長に就任 秦順一が所長に就任 「キングスカイフロント夏の科学イベント」開始 |
| 2014年 | 慶應医学会に野村達次賞創設 |
| 2016年 | 「実中研サイエンスキャンプ(実中研主催。子どもゆめ基金助成事業)」開始 第63回日本実験動物学会総会開催・大会長:伊藤守 |
| 2017年 | ライブイメージングセンターを新設 |
| 2020年 | 第3回日本医療研究開発大賞 健康・医療戦略担当大臣賞を受賞 伊藤守が所長に就任 |
| 2021年 | ICH S1Bガイドライン補遺において、rasH2マウスの名前が正式に記載され、世界標準システムとして認知 |
| 2022年 | 「六匹のマウスから3 ―実中研流 世界標準システムのつくり方」出版(野村龍太著) 5月15日に創立70周年 |
| 2023年 | 末松誠が所長に就任 |
| 2024年 | 公益財団法人実中研(英語名称:Central Institute for Experimental Medicine and Life Science)に法人名変更 |
実中研は1957年に文部省所管の財団法人として認定を受けていたが、2008年の公益法人制度改革により、新たに2011年4月1日付で「学術及び科学技術の振興を目的とする事業」を行う公益機関として内閣総理大臣所管の公益財団法人に認定された。同年7月には、川崎市川崎区殿町地区に整備された「キングスカイフロント」に新研究所を開設し、宮前区野川から全面移転した。新研究所は3年間の構想をもとに建設された最先端の実験動物施設で、この新天地でさらなる進展を目指して研究開発事業に着手した。なお、このキングスカイフロント地区は2011年12月に「国際戦略特区」に認定され、さらに大きく発展することになる。

川崎市は2011年3月に、いすゞ自動車川崎工場跡地の川崎区殿町3丁目地区を「キングスカイフロント」と命名して、健康・医療分野における世界最先端の研究開発分野の地区に構築する都市再開発事業を本格的にスタートさせた。さらにこの事業を進展させるために、神奈川県、横浜市との3者で「国際戦略特区」への申請を行い、2011年12月22日に「京浜臨海部ライフイノベーション国際戦略総合特区」として認定された。現在この地区には、大学・研究機関・企業など70機関以上が進出している。
実中研は、川崎市の誘致に応えてこのキングスカイフロントに最初に進出し、この地区の中核的な機関としての役割を担って研究開発事業を展開している。
実中研は1974年に川崎市宮前区野川に全部門を集結して研究開発事業を展開してきたが、2000年代に入ると施設全体の老朽化が進み、建物の大々的な改築と空調設備を始めとする付属機械類の全面的な交換が必要となってきた。しかしながら資金面で解決策を見出せずにいた。そのような状況下、2008年に川崎市から川崎区殿町の都市再開発地区への移転の話を持ち込まれた。ありがたいことにこの話には、川崎市の努力によって実現した経済産業省からの施設建設費の1/3補助制度を利用できることが含まれていた。この経済産業省の補助金と、野川の土地の売却費等によって新研究所建設の目処が立ち、移転計画が具体化することになった。これを受けて同年に、施工管理を野川施設の建築に携わった千代田テクノエース(株)が受け持つことになり、所の建設委員会との間で施設建設の話し合いが開始された。最初に話し合われたのは、川崎市から借用する土地は多摩川を挟んで羽田空港に隣接していたことによる高さ制限(25m以下)で、その中でどのような施設を建築できるかであった。さらに新施設に盛り込むべき具体的機能や付属機械類の詳細等がつめられて、2010年4月に工事が開始された。
一方、所としてはこれまでの研究テーマと事業内容を全面的に見直し、集中すべき課題を明確化した。新研究所建設にあたってのコンセプトは以下の通りである。
①動物種をマウスとコモンマーモセットに絞り込み、それら動物の開発と、それらの動物を用いた動物実験システムの開発を行う。
②マウスとマーモセット、そしてモニタリングセンター(MC)を階で分ける。両動物種は飼育方法が異なり、MCは外部機関から検査動物が持ち込まれるためである。さらにこれら3つの階の動物の交差を避けるため、異なる出入り口や動物用エレベーターを確保する。
③動物施設は、新しい空調システムの採用による省エネ施設(アクアクリーン:動物施設の排気再利用、モジュール別風量調整装置[VAV]:換気回数の削減)とする。
④動物室と実験室のモジュール化(3.1m×6.2m)によって、交互使用変更を可能にする。
⑤動物施設に外周廊下を設置し、動物室の温湿度管理を容易にするとともに防音や結露防止効果を期待する。
⑥歩行天井を確保し、動物室内に立ち入ることをなく施設設備のメンテナンスを可能にする。
⑦非常電源として、重油発電とガスタービン発電の2方式(動物空調機、冷凍庫など)を準備する。
⑧居室は大部屋とし、職員相互の意見交換を促進する。
その結果、新施設は敷地面積6,000㎡・延べ施設面積11,600㎡、5階建となった。また、この施設で働く人員は、当初100名を想定した。
新研究所は、構想から3年間を経て2011年7月に完成し、関係者、地元の方々をお招きして盛大に開所式が開催された。

2013年1月11日に、野村達次理事長・所長が逝去した。享年90歳であった。1952年に実中研を創立して以来所長を務め、さらに2006年からは理事長も併任した。その間、実験動物および動物実験に関わる研究と事業を積極的に展開し、実験動物の考え方の基礎を確立して、実験動物科学のみならず関連研究分野に多大な貢献を果たしてきた。その活躍の場は日本国内にとどまらず、日米科学会議実験動物部門の日本側代表や国際実験動物学会議役員(財務担当理事・副理事長)など世界的なものであった。国内では1984年紫綬褒章、1992年吉川英治文化賞、1997年文化功労者顕彰等を、国外では1988年 ICLASミュールボック記念賞、1998年・2000年米国FDA(食品医薬品局)特別功労賞、2005年ICLASマリー・コーツ賞等を受賞している。

「キングスカイフロント夏の科学イベント」(実行委員会:野村龍太実行委員長)はキングスカイフロントに進出している大学や研究機関、企業が、それぞれの事業内容を活かして科学技術を身近なものとして小学生に紹介する体験型イベントで、2013年に開始された。実中研は第1回目から参加し、小学生達に理科や科学に慣れ親しんでもらうようなイベントを企画して多くの反響が寄せられている他、実中研にとって多くの方々と接点を持てる大切な機会と捉えている。
野村達次理事長・所長が逝去した翌年の2014年に、母校である慶應義塾大学医学部の慶應医学会に「野村達次賞」が創設された。実中研として大変名誉なことである。慶應医学会ホームページの会長挨拶には、賞創設の趣旨が以下のように述べられている。
「(会長挨拶)野村達次博士は慶應義塾大学医学部の24回生です。博士は平成25年1月11日にご逝去されましたが、実験動物中央研究所の理事長、所長として終始一貫、医学の発展のために欠くことのできない良質の実験動物の創出と、plurality
standard とreproducibility
を追求できる包括的な動物実験システムの確立に一生を捧げられました。そのルーツは1947年、ご母堂の野村増子さま、姉君の美智子さまが大磯の野村邸でマウスの飼育を始めたことに端を発していることはあまりにも有名ですが、動物実験学のボトムアップを図るための苦闘の歴史を経て、独立自尊の精神そのままに苦難を克服し、世界に冠たる動物実験システムを創出されてきました。慶應医学会は「In
vivo実験医学」を長年に亘り牽引されてきた博士のご業績を永くたたえるため、「野村達次賞」を創設しました。野村博士は常に「明確な臨床を見据えた動物実験医学の展開」にこだわり続けた研究者でした。賞の創設を契機に、In
vivo実験医学がさらに発展し、真に世界に真価を問う斬新な医学研究が発展することを願って止みません。」(慶應医学会ホームページから転載)
「生命の誕生から身体のできるまでを知ろう」をテーマに2016年から実中研が主催している。子どもたちが理科や科学に触れ親しむ活動を通じて、理解や興味関心を深めることを目的としていて、国立青少年教育振興事業の子どもゆめ基金の助成を受けている。対象は中学生で毎回定員を越える応募がありニーズの高さが伺える。イベントでは生命の誕生から身体ができるまでについて授業を行い、体験活動ではDNAの抽出実験やマウスの受精卵の観察、細胞組織の染色や観察を実施している。参加者1人1人が体験活動を行うことを重視し、自宅学習としても活用できるテキストやDVD、プレパラートを作成するなど工夫を凝らし好評を博している。

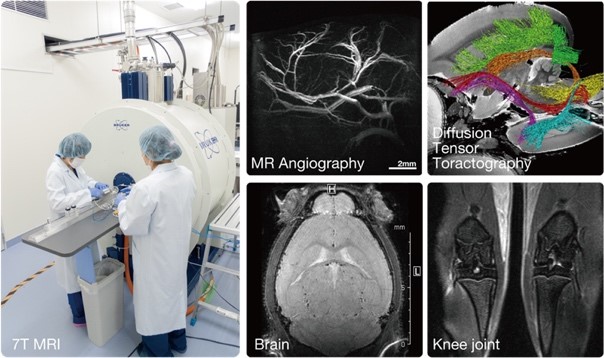
In vivo実験医学において我々の目指している最終ゴールは、ヒトの生命機能の解明と病気の克服である。そのために実中研では多くの年月をかけて画像解析基盤技術の整備を進めてきたが、2017年に新たにライブイメージングセンターを新設した。前身の画像解析研究室時代から10年以上一貫して、磁気共鳴画像装置(MRI)、マイクロX線CTを用いたIn vivoイメージングの基盤整備を行ってきた。In vivoイメージングの最大の利点は、1匹の動物を対象として非侵襲かつ経時的に観察することができることである。現在、動物実験において重要な課題の一つである、実験動物の代替(Replacement)、削減(Reduction)、苦痛の軽減(Refinement)の3Rsに役立つ強力な手法であり、実験動物科学に貢献することができる。また、この特性を活かして、In vivoイメージンングは様々な疾患モデル動物のダイナミックな病態変化を観察することができ、さらに疾患に対する治療前後の評価を行うPOC(proof of concept:概念実証)試験やヒトの臨床試験へつなげるトランスレーショナル・リサーチ(橋渡し研究)を加速させることが可能となる。
実中研は2020年1月10日に、「最先端実験動物の開発による医療分野の研究開発への貢献」に関して、第3回日本医療研究開発大賞
健康・医療戦略担当大臣賞を受賞した。日本医療研究開発大賞は、医療分野の研究開発の推進に多大な貢献をした事例に関して、功績を称えることにより、国民の関心と理解を深めるとともに、研究者等のインセンティブを高めるための賞で、「健康・医療戦略担当大臣賞」は、「特に顕著な功績が認められた事例(1件)」に贈られるもの、とされている。
実中研は1952年の設立以来、実験動物の飼育技術の確立、動物の品質管理の研究を行い、日本の実験動物学の発展に大きく寄与してきた。また、臨床と基礎を結ぶトランスレーショナル研究のための動物実験システムの開発と提供を行い、インビボ実験医学という科学領域を確立した。今回の受賞は、創立以来のこれまでの活動を包括し、実験動物学を通して医療の発展に寄与した功績に対して与えられたものと考えている。

rasH2マウスはヒトのがん遺伝子(c-Ha-ras)を導入したトランスジェニック動物で、1990年に実中研と東海大学、国立がんセンターとの共同研究で開発された。さらに1993年から、慶應義塾大学、国立医薬品食品衛生研究所と共同で、発がん性試験のための実用化研究が開始された。最初にrasH2マウスの量産体制が確立され、つぎに発がん性試験に使用できるか、従来法との優劣が比較検討された。その結果、従来法では2年間かかる試験期間がrasH2マウスでは約6カ月と、当初の予想を大幅に短縮できることが判明した。さらに1997年から2001年の5年間に国際生命科学研究所(International Life Science Institute)と健康環境科学研究所(Health and Environmental Science Institute)の主導のもとに、日・米・EUの産官学50以上の施設が連携した検証試験が実施され、rasH2マウスは他の評価モデルよりも有用性の高いことが確認された。以降、特に米国製薬企業での利用経験が増えるにしたがい、本マウス試験を有効に使うことによる“証拠の重みづけアプローチ”に基づく新たな医薬品の発がん性評価法の可能性を探る議論が開始された。そして、2021年に医薬品規制調和国際会議(ICH: International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use)のガイドラインS1B 補遺(ICH S1B(R1))において、rasH2マウスが遺伝子改変マウスを用いたがん原性試験の世界標準動物として個別名称と具体的利用法が掲載された。
PAGE TOP